Comirnaty: il vaccino della Pfizer-BioNTech. ~ La storia ~
di Denise Matticoli
🟢 Innanzitutto diamo dei semplici dati, già noti, ma è bene ricordarli.
▪ Il nome commerciale del vaccino è Comirnaty. Ma nell’ambito prettamente medico- scientifico è conosciuto col nome BNT162b2, e anche col nome del suo principio attivo: Tozinameran.
▪ Sappiamo che ha un’efficacia comprovata del 95%.
▪ Deve essere somministrato in 2 dosi: la prima dose è solo l’inizio, poi a distanza di 3 settimane è necessario il richiamo per rendere il vaccino definitivamente efficace.
▪ È somministrato con iniezioni intra-muscolari.
▪ Ciò che rende difficile la distribuzione di questo vaccino, come sappiamo, è la necessità di conservarlo ad una temperatura ampiamente sotto zero, ovvero a -70°.

🟢Il vaccino Comirnaty è stato approvato in Europa dall’EMA (European Medicines Agency) il 21 dicembre 2020.
Vi ricordiamo che l’EMA è l’agenzia comunitaria dell’Unione Europea per la valutazione dei medicinali che ha sede ad Amsterdam.
▪ Così il 21 dicembre veniva annunciata la notizia dalla Commissione Europea:
«Oggi, la Commissione Europea ha dato l’autorizzazione alla vendita sottoposta a specifiche condizioni del vaccino per il Covid-19, sviluppato dalle aziende BioNTech e Pfizer, il quale vaccino risulta essere il 1° ad essere stato autorizzato in Europa.
Questa autorizzazione deriva da valutazioni scientifiche positive, basate su una completa disamina della sicurezza, efficacia e qualità del vaccino da parte dell’Ema ed è supportata dagli Stati Menbri.»
Ursula von der Leyen, la Presidente della Commissione Europea, diceva: «Abbiamo approvato il 1° vaccino sicuro ed efficace contro il Covid-19. Presto arriveranno altri vaccini (…)»
▪ Nella dichiarazione ufficiale della commissione Europea del 21 dicembre era spiegato cos’è una CMA, ovvero una ‘Conditional Marketing Authorisation’: si tratta di una autorizzazione ad immettere sul mercato dei farmaci, rilasciata sulle basi di dati ancora non completi.
▪Questa autorizzazione viene data considerando attentamente i benefici di un farmaco immediatamente disponibile, e viene data se i benefici superano di molto i rischi collegati al fatto che la sperimentazione non è del tutto completata.
Come sottolinea sul proprio sito ufficiale, l’Ema supporta questo tipo di autorizzazione nel caso di un’emergenza in corso per la salute pubblica, come nel caso di una Pandemia.
▪ Però la Commissione Europea sottolinea che comunque, una volta concessa questa autorizzazione di emergenza, le aziende devono fornire ulteriori dati scientifici entro precise scadenze, da quel momento in poi, o addirittura nuovi studi, che confermino che i benefici continuino a superare i rischi.
⚠ Vogliamo sottolineare un aspetto importante: al momento della sua approvazione in Europa, il vaccino Comirnaty ha comunque superato le 3 fasi sperimentali richieste per verificare la sicurezza e l’efficacia del vaccino, e i suoi eventuali effetti collaterali.
Ciò è stato possibile perché la Pfizer e la BioNTech per riuscire a velocizzare la ricerca sul loro vaccino, hanno proceduto a studiarlo combinando le 3 fasi.
Anche su questo passaggio ci ritorneremo per fare chiarezza in un ulteriore articolo.
🟢La Pfizer è un’azienda farmaceutica di New York, la BioNTech è invece tedesca.
▪ Il 9 Novembre 2020 queste 2 aziende hanno letteralmente ‘fatto la storia’, presentando dei dati preliminari che indicavano che il loro vaccino per il Covid-19 aveva una percentuale di efficacia sopra il 90%.
▪ Soltanto 1 mese dopo, l’11 dicembre 2020, la FDA (Food and Drug Administration) dava la 1° autorizzazione ad uso emergenziale dell’uso di Comirnaty.
Questa è la prima autorizzazione data dagli stati Uniti all’uso di un vaccino per il SARS-CoV-2.
Vi ricordiamo che «La Food and Drug Administration (‘Agenzia per gli alimenti e i medicinali’, abbreviato in FDA) è l’ente governativo statunitense che si occupa della regolamentazione dei prodotti alimentari e farmaceutici, dipendente dal Dipartimento della salute e dei servizi umani degli Stati Uniti d’America.»
🟢I ricercatori della BioNTech iniziarono a progettare il vaccino nel gennaio del 2020.
Lo impostarono sulla molecola genetica conosciuta come RNA messaggero (mRNA).
▪ Il vaccino contiene le istruzioni genetiche che consentono alla cellula umana di costruire una proteina del coronavirus SARS-CoV-2, famosa ormai come proteina SPIKE.
▪ Quindi, nel momento in cui Comirnaty entra nelle nostre cellule, consente loro di costruire le proteine spike, che una volta rilasciate nel corpo, inducono la risposta del nostro sistema immunitario, il quale grazie al vaccino impara a riconoscerle.
🟢 Per velocizzare ed espandere la ricerca, la BioNTech ha iniziato a collaborare con la Pfizer a marzo 2020, lanciando un primo test clinico a maggio 2020.
▪ Scoprirono che il Comirnaty produceva nei volontari gli anticorpi contro il SARS-CoV-2, e allo stesso tempo produceva le cellule T, quelle che rispondono ai virus con l’attivazione della risposta immunitaria.
▪ Il 27 giugno le 2 aziende annunciarono l’inizio dei test combinando la fase 2 e la fase 3, sperimentando il vaccino su 30.000 volontari provenienti dagli Stati Uniti, e da altri paesi come l’Argentina, il Brasile e la Germania.
▪ Il 12 settembre la Pfizer e la BioNTech annunciarono che avrebbero cercato di espandere la sperimentazione a 44.000 partecipanti.
▪ L’8 novembre le 2 aziende pubblicarono le analisi preliminari sui primi 94 individui testati.
▪ Nei mesi successivi la Pfizer e la BioNTech continuarono a fornire ancora più dati con l’aumentare delle persone testate.
🟢L’8 dicembre 2020 la FDA pubblicò la sua analisi indipendente delle sperimentazioni cliniche.
▪ Rilevarono
- che il Comirnaty ha un’efficacia del 95%.
- che il principio attivo del vaccino, Tozinameran, cominciava a proteggere i volontari meno di 2 settimane dopo la prima dose, rafforzando la risposta immunitaria con la seconda dose, il richiamo, effettuata 3 settimane dopo.
▪ È importante sottolineare che il vaccino mostrava minime differenze nella sua azione protettrice rispetto ai volontari testati di diverse etnie, quindi rispetto alle persone di carnagione bianca, agli afro-americani, e ai latino-americani.
▪ Le persone con malattie pregresse, come l’obesità e il diabete, usufruivano dello stesso livello di protezione degli altri volontari.
▪ Anche gli anziani giovavano dello stesso livello di efficacia rilevato nelle persone sotto i 65 anni.
▪ Il vaccino Comirnaty generalmente non causa effetti collaterali gravi. Può invece causare effetti collaterali leggeri di breve durata come affaticamento, febbre e dolori muscolari.

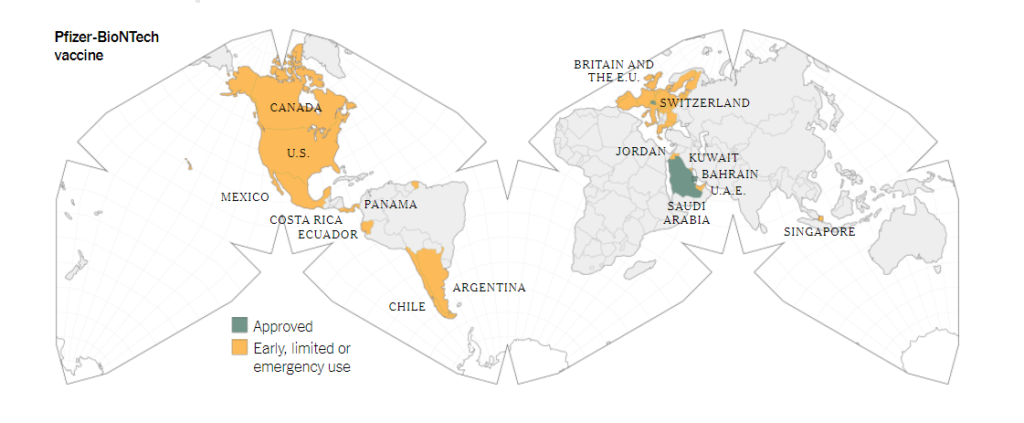
🟢Questi straordinari risultati hanno rapidamente portato alle autorizzazioni in vari paesi del mondo.
▪ Il 2 dicembre 2020 la Gran Bretagna diede l’autorizzazione di emergenza al vaccino Comirnaty.
La Gran Bretagna quindi è stata il primo paese occidentale a dare l’approvazione al primo vaccino per il SARS-CoV-2.
La somministrazione nel Regno Unito è iniziata con William Shakespeare, un cittadino di 81 anni.
▪ Un crescente numero di Paesi hanno poi dato l’autorizzazione di emergenza per la somministrazione di Comirnaty, fra cui l’Argentina, il Canada, il Cile, la Costa Rica, l’Ecuador, la Giordania, il Kuwait, il Messico, Panama, e Singapore.
🟢La distribuzione del vaccino Comirnaty dipenderà in parte dagli accordi che la Pfizer e la BioNTech hanno fatto, iniziando proprio dalla scorsa estate.
▪ L’amministrazione di Donald Trump (USA) si era assicurata a luglio 100 milioni di dosi, con un contratto di 1 miliardo e 900.000 dollari! Dopo altre trattative, nel mese di dicembre gli Stati Uniti si sono accordati con le 2 aziende per ricevere altri 100 milioni di dosi del vaccino entro luglio 2021.
▪ Nel frattempo il Giappone fece un accordo per ricevere 120 milioni di dosi.
▪ Contemporaneamente l’Unione Europea si accordò per l’acquisto di 300 milioni di dosi.
▪ Il 16 dicembre la BioNTech annunciò l’accordo con la Cina per la fornitura di 100 milioni di dosi. Questo accordo ha reso il Comirnaty il primo vaccino occidentale ad essere venduto in Cina.
🟢 In Italia abbiamo avuto il famoso ‘V-day’ (Vaccine day), il Giorno del Vaccino, il 27 dicembre 2020, con il quale si è ufficialmente aperta la campagna di vaccinazione.
►Il Ministero della Salute ha precisato che l’Italia riceverà complessivamente 26,92 milioni di dosi di vaccino Pfizer-BioNTech.
I primi 8,749 milioni di dosi sarebbero garantite entro il primo trimestre del 2021. L’approvvigionamento di Comirnaty in Italia pare corrisponda a 470.000 dosi settimanali.
🟢La Pfizer e la BioNTech hanno programmato di produrre più di 1 miliardo e 300 milioni di dosi del loro vaccino in tutto il mondo, entro la fine del 2021.